EMBL co-develops new method that could facilitate cancer diagnosis
EMBL co-develops new method that could facilitate cancer diagnosis
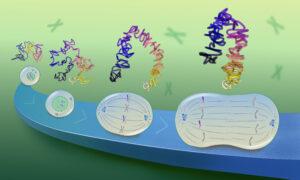
Researchers led by EMBL and the Center for Bioinformatics at Saarland University in Saarbrücken have developed a cheaper and faster method to check for genetic differences in individual cells, which outperforms existing techniques with respect to the information received. This new method could become a new standard in single cell research, and potentially for clinical diagnosis in disease genetics, including cancer. The results have been published in Nature Biotechnology.
“Our new method to study genetic variations in individual cells could transform the field of mutation detection,” highlights Ashley Sanders, one of the lead authors of the study, working at EMBL Heidelberg. The method she and her colleagues developed – termed scTRIP (single cell tri-channel processing) – allows them to study genetic variations within the DNA of a single cell and measure genetic variations directly as they form in new cells. In contrast to existing methods that were able to detect only large-scale changes in the genome, scTRIP can detect small-scale changes, along with many types of genetic variations that were invisible using other single cell methods.
The researchers tested their method in studying patient-derived leukaemia cells. In their sample, the team found four times more variants in the patient than were detected by standard clinical diagnostics. These included a missed clinically relevant translocation that drove the overexpression of a cancer-causing gene. They also observed a catastrophic chromosome rearrangement that was missed in the initial leukaemia diagnosis. It probably occurred when a single chromosome shattered and was then glued back together in a rearranged order.
“These first results show that our method is outperforming existing ones significantly. Our method is much faster and cheaper than methods currently in use to uncover genetic variants in single cells. This might be very useful for clinical applications,” summarises Tobias Marschall, from the Center for Bioinformatics at Saarland University and the Max Planck Institute for Informatics. The team has begun to expand their use of the method to analyse different forms of leukaemia and evaluate its potential clinical utility.
As the heterogeneity of a sample can best be studied at a single-cell level, researchers all over the world – including several groups at EMBL – are working on the development of technologies to improve the information received. “While existing techniques show how different cells can behave or respond to manipulation or treatment, research and application have so far centred on measuring the RNA within a cell. However, measuring the DNA in a single cell has so far received much less attention,” explains Tobias Marschall. As it is expected that looking at the DNA will provide a new level of understanding in how these genetic changes drive different cell behaviours, the new method addresses the needs of both researchers and medical doctors.
scTRIP is based on a technology Ashley Sanders co-developed during her PhD in Vancouver. “scTRIP combines signals from three distinct channels of information from within the genomic code of the individual cell,” explains Jan Korbel, group leader at EMBL Heidelberg. “Doing so, our method allows us to uncover the full spectrum of DNA rearrangements in individual cells.”
Now, using scTRIP, the researchers are continuing their research on a very basic question: How much does one cell in the body differ from any other cell, in the context of cancer as well as in normal cells? Until now, they were unable to address this question because they lacked the technology to do so. “Using scTRIP we can now directly measure the mutational processes that act in cells to generate new genetically distinct populations,” says Ashley Sanders. For the next steps in their research, the team plans to study mutational processes in different human cell types, and to assess the consequences these differences have in terms of human diseases.
EMBL entwickelt in Zusammenarbeit eine neue Methode, die die Krebsdiagnose erleichtern könnte – Schneller, kostengünstiger und detaillierter
Forscher unter der Leitung des Europäischen Laboratoriums für Molekularbiologie (EMBL) in Heidelberg und des Zentrums für Bioinformatik der Universität des Saarlandes in Saarbrücken, Deutschland, haben eine kostengünstigere und schnellere Methode entwickelt, um auf genetische Unterschiede in einzelnen Zellen zu prüfen, die die bestehenden Techniken in Bezug auf die erhaltenen Informationen übertrifft. Diese neue Methode könnte zu einem neuen Standard in der Einzelzellforschung und möglicherweise zur klinischen Diagnose in der Krankheits-Genetik, einschließlich Krebs, werden. Die Ergebnisse wurden in Nature Biotechnology veröffentlicht.
“Unsere neue Methode zur Untersuchung genetischer Variationen in einzelnen Zellen könnte das Fachgebiet des Mutationsnachweis verändern”, betont Ashley Sanders, einer der Hauptautoren der Studie, die am EMBL Heidelberg arbeitet. Mit der von ihr und ihren Kollegen entwickelten Methode – scTRIP (single cell tri-channel processing) – können sie genetische Variationen in der DNA einer einzelnen Zelle untersuchen und diese direkt bei der Bildung in neuen Zellen messen. Im Gegensatz zu den bisherigen Methoden, die nur große Veränderungen im Genom erkennen konnten, kann scTRIP kleine Veränderungen sowie viele Arten von genetischen Variationen erkennen, die mit anderen Einzelzellmethoden nicht sichtbar sind.
Die Forscher testeten ihre Methode bei der Untersuchung von Leukämiezellen, die von Patienten stammen. In deren Proben fand das Team viermal mehr Varianten im Patienten, als in der klinischen Standarddiagnostik nachgewiesen wurden. Dazu gehörte eine fehlende, klinisch relevante Translokation, die die Überexpression eines krebserregenden Gens verursachte. Sie beobachteten weiterhin eine katastrophale Chromosomenumlagerung, die bei der ersten Leukämiediagnose übersehen wurde. Dies geschah wahrscheinlich, als ein einzelnes Chromosom zerbrach und dann in umgekehrter Reihenfolge wieder zusammenklebte.
“Diese ersten Ergebnisse zeigen, dass unsere Methode die bestehenden deutlich übertrifft. Unsere Methode ist viel schneller und kostengünstiger als die derzeit eingesetzten Methoden zur Aufdeckung genetischer Varianten in Einzelzellen. Das könnte für klinische Anwendungen sehr nützlich sein” , fasst Tobias Marschall vom Zentrum für Bioinformatik der Universität des Saarlandes und vom Max-Planck-Institut für Informatik zusammen. Das Team hat damit begonnen, den Einsatz der Methode zur Analyse verschiedener Formen von Leukämie zu erweitern und den potenziellen klinischen Nutzen zu bewerten.
Da die Heterogenität einer Probe am besten auf Einzelzellebene untersucht werden kann, haben Forscher auf der ganzen Welt – darunter mehrere Gruppen am EMBL – an der Entwicklung von Technologien zur Verbesserung der erhaltenen Informationen gearbeitet. “Während bestehende Techniken zeigen, wie sich verschiedene Zellen verhalten oder auf Manipulation oder Behandlung reagieren können, konzentrieren sich Forschung und Anwendung bisher auf die Messung der RNA in einer Zelle. Die Messung der DNA in einer einzelnen Zelle hat jedoch bisher deutlich weniger Beachtung gefunden” , erklärt Tobias Marschall. Da es erwartet wird, dass der Blick auf die DNA ein neues Verständnis dafür liefern wird, wie diese genetischen Veränderungen das Verhalten der Zellen beeinflussen, richtet sich die neue Methode an die Bedürfnisse von Forschern und Ärzten.
scTRIP basiert auf einer Technologie, die Ashley Sanders während ihrer Promotion in Vancouver mitentwickelt hat. “scTRIP kombiniert Signale aus drei verschiedenen Informationskanälen innerhalb des genomischen Codes der einzelnen Zellen”, erklärt Jan Korbel, Gruppenleiter am EMBL Heidelberg. “Auf diese Weise können wir mit unserer Methode das gesamte Spektrum der DNA-Umlagerungen in einzelnen Zellen aufdecken.”
Mit scTRIP setzen die Forscher nun ihre Forschung zu einer ganz grundlegenden Frage fort: Inwiefern unterscheidet sich eine Zelle im Körper von jeder anderen Zelle, sowohl im Zusammenhang mit Krebs als auch in normalen Zellen? Bisher konnten sie diese Frage nicht beantworten, weil ihnen die Technologie dazu fehlte. “Mit scTRIP können wir nun direkt die Mutationsprozesse messen, die in Zellen ablaufen, um neue genetisch unterschiedliche Populationen zu erzeugen” , sagt Ashley Sanders. Für die nächsten Forschungsschritte plant das Team, Mutationsprozesse in verschiedenen menschlichen Zelltypen zu untersuchen und die Auswirkungen zu bewerten, die diese Unterschiede auf die Krankheiten des Menschen haben.
EMBL desarrolla un nuevo método que podría facilitar el diagnóstico del cáncer – de forma más rápida, económica y detallada
Los investigadores del Laboratorio Europeo de Biología Molecular (EMBL) en Heidelberg y el Centro de Bioinformática de la Universidad de Saarland en Saarbrücken, Alemania, han desarrollado un método más barato y rápido para verificar las diferencias genéticas en células individuales, que es mucho más efectivo en el tratamiento de la información recibida que las técnicas existentes. Este nuevo método podría convertirse en un nuevo referente de la investigación unicelular, especialmente en lo que concierne al diagnóstico clínico en genética de enfermedades, incluido el cáncer. Los resultados han sido publicados en Nature Biotechnology.
«Nuestro nuevo método para estudiar las variaciones genéticas en células individuales podría transformar el campo de la detección de mutaciones», destaca Ashley Sanders, una de las autoras principales del estudio y empleada del EMBL Heidelberg, Alemania. Ella y sus compañeros desarrollaron un método llamado scTRIP (procesamiento de una sola célula en tres canales), que les permite estudiar las variaciones genéticas en el ADN de una sola célula y medir directamente las variaciones genéticas a medida que se forman en nuevas células. A diferencia de los métodos existentes que solo son capaces de detectar cambios a gran escala en el genoma, scTRIP puede detectar cambios a pequeña escala, además de diversos tipos de variaciones genéticas que eran imposibles de detectar utilizando otros métodos unicelulares.
Los investigadores probaron su método para estudiar las células de pacientes con leucemia. En su muestra, el equipo encontró cuatro veces más variantes en el paciente que las detectadas por los diagnósticos clínicos estándar. Estas evidenciaron la existencia de una translocación clínicamente relevante que pasó desapercibida y que llevó a la sobreexpresión de un gen causante de cáncer. También observaron un reordenamiento catastrófico de los cromosomas, que no se detectó en el diagnóstico inicial de leucemia, y que probablemente se debió a la ruptura de un solo cromosoma, que al adherirse de nuevo, lo hizo en un nuevo orden.
«Estos primeros resultados muestran que nuestro método está superando significativamente a los existentes. Nuestro método es mucho más rápido y barato que los métodos que se utilizan en la actualidad para descubrir variantes genéticas en células individuales. Esto podría ser muy útil para aplicaciones clínicas», afirma Tobias Marschall, del Centro de Bioinformática en la Universidad de Saarland y del Instituto Max Planck de Informática. El equipo ha comenzado a ampliar el uso del método para analizar diferentes formas de leucemia y evaluar su potencial de utilidad clínica.
Como la heterogeneidad de una muestra puede estudiarse mejor a nivel unicelular, investigadores de todo el mundo, incluyendo varios grupos en el EMBL, están trabajando en el desarrollo de tecnologías para mejorar la información recibida. «Mientras que las técnicas existentes muestran cómo las diferentes células pueden comportarse o responder a la manipulación o al tratamiento, hasta ahora, tanto la investigación como la aplicación se han centrado en la medición del ARN de una célula. Sin embargo, la medición del ADN en una sola célula ha recibido mucha menos atención», explica Tobias Marschall. Como se espera que la observación del ADN proporcione un nuevo nivel de comprensión de cómo estos cambios genéticos originan diferentes comportamientos celulares, el nuevo método aborda las necesidades tanto de los investigadores como de los médicos.
scTRIP está basado en una tecnología que Ashley Sanders desarrolló durante su doctorado en Vancouver. «scTRIP combina señales de tres canales de información distintos dentro del código genómico de la célula individual», explica Jan Korbel, líder del grupo EMBL Heidelberg. «Al hacerlo, nuestro método nos permite descubrir el espectro completo de reordenamientos de ADN en células individuales. »
Ahora, mediante scTRIP, los investigadores continúan su investigación preguntándose lo siguiente: en situaciones con pacientes con cáncer y pacientes sanos, ¿qué es lo que diferencia a unas células de otras? Hasta ahora, no podían responder a esta pregunta porque carecían de la tecnología para hacerlo. «Mediante scTRIP ahora podemos medir directamente los procesos mutacionales que actúan en las células para generar nuevas poblaciones genéticamente distintas», dice Ashley Sanders. En las próximas etapas en su investigación, el equipo planea estudiar procesos mutacionales en diferentes tipos de células humanas y evaluar las consecuencias que estas diferencias tienen en términos de enfermedades humanas.
L’EMBL co-développe une nouvelle méthode qui pourrait faciliter le diagnostic du cancer – plus rapide, moins coûteuse et plus détaillée
Des chercheurs du Laboratoire européen de biologie moléculaire (EMBL) de Heidelberg et du Centre de Bioinformatique de l’Université de Sarre à Sarrebruck, en Allemagne, ont mis au point une méthode moins coûteuse et plus rapide pour vérifier les différences génétiques des cellules individuelles, qui dépasse les techniques existantes en termes d’informations reçues. Cette nouvelle méthode pourrait devenir une nouvelle norme dans la recherche sur les cellules uniques et, éventuellement, pour le diagnostic clinique en génétique des maladies, y compris le cancer. Les résultats ont été publiés dans Nature Biotechnology.
« Notre nouvelle méthode d’étude des variations génétiques dans les cellules individuelles pourrait transformer le domaine de la détection des mutations », souligne Ashley Sanders, l’un des principaux auteurs de l’étude, travaillant à l’EMBL de Heidelberg, en Allemagne. La méthode qu’elle et ses collègues ont mise au point, appelée scTRIP (traitement tri-canal à cellule unique), leur permet d’étudier les variations génétiques dans l’ADN d’une seule cellule et de mesurer directement les variations génétiques lorsqu’elles se forment dans de nouvelles cellules. Contrairement aux méthodes existantes qui ne permettaient de détecter que des changements à grande échelle dans le génome, le scTRIP peut détecter des changements à petite échelle, ainsi que de nombreux types de variations génétiques qui étaient invisibles en utilisant d’autres méthodes à cellule unique.
Les chercheurs ont testé leur méthode en étudiant des cellules leucémiques dérivées de patients. Dans leur échantillon, l’équipe a trouvé quatre fois plus de variantes chez le patient que ce qui avait été détecté par les diagnostics cliniques standard. Cela inclut notamment une translocation cliniquement pertinente manquée qui a entraîné la surexpression d’un gène cancérigène. Ils ont également observé un réarrangement chromosomique catastrophique qui n’avait pas été détecté lors du diagnostic initial de la leucémie. Cela s’est probablement produit lorsqu’un chromosome s’est brisé et a ensuite été recollé dans un nouvel ordre.
« Ces premiers résultats montrent que notre méthode surpasse largement les méthodes existantes. Notre méthode est beaucoup plus rapide et moins coûteuse que les méthodes actuellement utilisées pour détecter des variantes génétiques dans les cellules individuelles. Cela pourrait être très utile pour des applications cliniques », résume Tobias Marschall, du Center de Bioinformatique de l’Université de la Sarre et de l’Institut d’Informatique Max Planck. L’équipe a commencé à étendre son utilisation de la méthode pour analyser différentes formes de leucémie et évaluer son utilité clinique potentielle.
Comme l’hétérogénéité d’un échantillon peut être étudiée au mieux au niveau d’une seule cellule, les chercheurs du monde entier – y compris plusieurs groupes à l’EMBL – travaillent à l’élaboration de technologies visant à améliorer les informations reçues. « Alors que les techniques existantes montrent comment différentes cellules peuvent se comporter ou réagir à la manipulation ou au traitement, la recherche et l’application se sont jusqu’à présent concentrées sur la mesure de l’ARN dans une cellule. Cependant, la mesure de l’ADN dans une cellule unique a jusqu’à présent reçu beaucoup moins d’attention », explique Tobias Marschall. Comme on s’attend à ce que l’examen de l’ADN permette de mieux comprendre comment ces changements génétiques entraînent différents comportements cellulaires, la nouvelle méthode répond aux besoins des chercheurs et des médecins.
Le scTRIP est basé sur une technologie qu’Ashley Sanders a co-développée durant son doctorat à Vancouver. « Le ScTRIP combine des signaux provenant de trois canaux d’information distincts provenant du code génomique de la cellule individuelle », explique Jan Korbel, chef de groupe à l’EMBL de Heidelberg. « Ainsi, notre méthode nous permet de détecter le spectre complet des réarrangements ADN dans les cellules individuelles. »
Aujourd’hui, à l’aide du scTRIP, les chercheurs poursuivent leurs recherches sur une question très simple : Dans quelle mesure une cellule du corps diffère-t-elle d’une autre cellule, dans le cas d’un cancer tout comme dans les cellules normales ? Jusqu’à présent, ils n’étaient pas en mesure de répondre à cette question parce qu’ils n’avaient pas la technologie pour le faire. « Grâce au scTRIP, nous pouvons maintenant mesurer directement les processus mutationnels qui agissent dans les cellules pour générer de nouvelles populations génétiquement distinctes », explique Ashley Sanders. Pour les prochaines étapes de sa recherche, l’équipe prévoit d’étudier les processus mutationnels dans différents types de cellules humaines et d’évaluer les conséquences de ces différences en termes de maladies humaines.