Poo transplants better understood
New study expands potential applications for stool transplants while emphasising need for compatibility and personalised approach
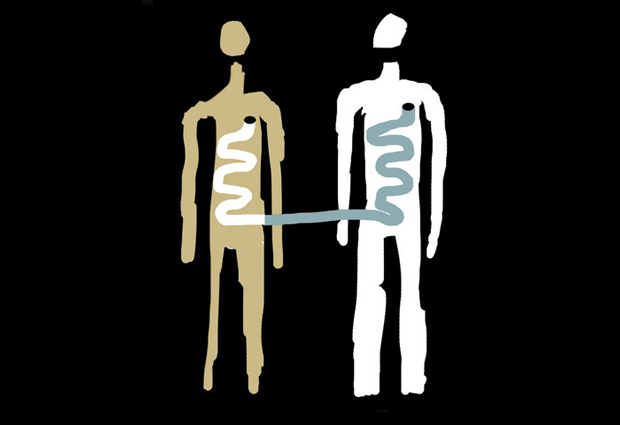
For the first time, scientists studying stool transplants have been able to track which strains of bacteria from a donor take hold in a patient’s gut after a transplant. The team, led by EMBL with collaborators at Wageningen University and the Academic Medical Centre, both in the Netherlands, and the University of Helsinki, Finland found that compatibility between donor and patient likely plays a bigger role in these transplants than previously thought. The study, published today in Science, could help make stool transplants a valid treatment option for more conditions than they are currently applied to.
“Ultimately, the goal is to move from a stool transplant to something more manageable, such as a pill,” says Simone Li, who carried out the work at EMBL. “Our work shows that this is likely going to be a personalised bacterial cocktail, rather than a one-size-fits-all solution.”
Stool transplants – also known as faecal microbiota transplants – involve taking microbes from the poo of a healthy donor and transferring them to the patient’s gut. The hope is that this will help to restore health to patients suffering from conditions where the normal balance of microbes in the gut gets skewed. The approach has been very successful for treating recurrent Clostridium difficile (C. diff) infections – which can cause life-threatening cases of diarrhoea, and are becoming a serious problem in hospitals and healthcare institutes. But for other conditions, like ulcerative colitis, stool transplants have proven much less effective. The current study, led by Peer Bork and Shinichi Sunagawa at EMBL, could help improve those odds. The trick, the scientists say, is to look beyond what species of microbes are in a person’s gut, to what strains of each species.
the goal is to move from a stool transplant to something more manageable, such as a pill
Most people have E. coli in their gut, for instance, but different people have different strains of this species – and some of those strains can cause health issues. By distinguishing between different strains, the EMBL scientists were able to track if the microbes in a patient’s gut after the treatment were their own or came from the donor.
They found that after a stool transplant, new strains of microbes from the donor were more likely to colonise a patient’s gut if the patient already had that species. This implies that if doctors can match donors to patients, the chances of the treatment being a success could improve considerably. Looking at strains rather than species of bacteria could also make the therapy effective in conditions where it isn’t currently working.
it could help to design stool transplants to work in other conditions beyond C. diff.
“With this method, we can really see if, for example, an antibiotic-resistant strain is replaced by a non-resistant one,” says microbiologist Willem de Vos, who led the work at Wageningen University and the University of Helsinki, “so it could help to design stool transplants to work in other conditions beyond C. diff.”
The study builds on a clinical trial that looked into the use of stool transplants as a treatment for metabolic syndrome, run by Max Nieuwdorp at the Academic Medical Centre in Amsterdam. Although based on data from only 10 people, the work already provides strong indications that donor-patient compatibility is more important than assumed: transplants from one donor led to very different outcomes in three different patients.
Stuhltransplantationen – ganz individuell
Eine neue Studie erweitert die potentiellen Anwendungsmöglichkeiten für Stuhltransplantationen. Gleichzeitig werden die Notwendigkeit der Verträglichkeit und ein personalisierter Ansatz hervorgehoben.
Zum ersten Mal ist es Wissenschaftlern bei der Untersuchung von Stuhltransplantationen gelungen, diejenigen Bakterienstämme des Spenders genau zu bestimmen, denen es nach einer Transplantation gelingt, sich im Darm des Empfängers anzusiedeln. Das von Wissenschaftlern am EMBL geführte Team fand zusammen mit Forschern der Universitäten Wageningen und Helsinki sowie des Akademisch-medizinischen Zentrums in Amsterdam heraus, dass die Kompatibilität zwischen Spender und Empfänger sehr wahrscheinlich eine wichtigere Rolle spielt als bisher angenommen. Die heute in der Fachzeitschrift Science veröffentlichte Studie könnte dazu beitragen, den Einsatz von Stuhltransplantationen als wirksame Therapieoption auf andere Krankheitsbilder zu erweitern.
“Letztendlich besteht das Ziel darin, eine Stuhltransplantation in Form einer Pille zu entwickeln,” so Simone Li, Wissenschaftlerin am EMBL. “Unsere Arbeit zeigt, dass es sich dabei höchstwahrscheinlich eher um einen personalisierten Bakteriencocktail handeln wird als um eine Patentlösung für alle.”
Bei Stuhltransplantationen – auch bekannt als fäkale Bakterientherapie – werden Mikroben aus dem Stuhl eines gesunden Spenders entnommen und in den Darm des Patienten transplantiert. Dadurch hofft man, die Gesundheit der Patienten wieder herzustellen, bei denen das normale Gleichgewicht der Mikroben im Darm durcheinander geraten ist. Der Ansatz hat sich als äußerst erfolgreich bei der Behandlung wiederkehrender Clostridium difficile (C. diff) Infektionen herausgestellt, die lebensbedrohliche Fälle von Durchfallerkrankungen hervorrufen können und zunehmend ein ernstes Problem in Krankenhäusern und anderen Gesundheitseinrichtungen darstellen. Bei anderen Krankheitsbildern wiederum, wie z. B. Colitis ulcerosa (Dickdarmentzündung), ist diese Methode weniger effektiv. Die aktuelle Studie unter Leitung von Peer Bork und Shinichi Sunagawa am EMBL könnte dies jedoch ändern. Der Trick, so die Wissenschaftler, besteht darin, sich statt der Bakterienarten im Darm eines Patienten die jeweiligen Bakterienstämme genauer anzuschauen.
So haben die meisten Menschen z.B. E. coli im Darm, aber die Stämme variieren von Mensch zu Mensch – und einige davon können gesundheitliche Probleme verursachen. Durch die Unterscheidung der Stämme konnten die Wissenschaftler am EMBL genau bestimmen, ob die Mikroben im Darm eines Patienten nach der Behandlung seine eigenen waren oder vom Spender stammten.
Sie fanden heraus, dass es nach einer Stuhltransplantation für neue Mikrobenstämme des Spenders wesentlich einfacher war, sich im Darm des Patienten anzusiedeln, wenn der Patient diesen Stamm bereits in sich trug. Dies deutet darauf hin, dass die Erfolgschancen einer Behandlung wesentlich verbessert werden können, wenn der Arzt Spender und Empfänger aufeinander abstimmen kann. Konzentriert man sich dabei stärker auf den Bakterienstamm als auf die Bakterienart, könnte dies auch zu effektiveren Therapien bei Krankheitsbildern führen, für die gegenwärtig noch keine wirksamen Therapien vorhanden sind.
“Mit dieser Methode können wir genau feststellen, ob z.B. ein antibiotikaresistenter Stamm durch einen nicht-resistenten ersetzt wird,” so Mikrobiologe Willem de Vos, der die Studie an den Universitäten Wageningen und Helsinki leitete: „Sie könnte also auch dazu dienen, spezielle Stuhltransplantationen für Patienten mit einem anderen Befund als C. diff. zu entwickeln.“
Die Studie baut auf einem klinischen Versuch von Max Nieuwdorp am Akademisch-medizinischen Zentrum in Amsterdam auf, in dem Stuhltransplantationen zur Behandlung des Metabolischen Syndroms eingesetzt wurden. Obwohl die Studie lediglich 10 Personen umfasste, deuten die Ergebnisse stark darauf hin, dass die Spender-Empfänger-Kompatibilität wichtiger ist als bisher angenommen: Transplantationen von ein und demselben Spender führten zu sehr unterschiedlichen Ergebnissen bei drei verschiedenen Patienten.