MEG3 kissing loops essential for tumour suppression

A team of researchers in the Marcia group at EMBL Grenoble have discovered that the tumour suppressor MEG3 adopts a complex three-dimensional structure to fulfil its function. Furthermore, they were able to fine-tune its activity by targeted manipulation of this architecture. The results of this study, published in Molecular Cell, might help to advance diagnosis and treatment of certain types of cancer.
The power and mystery of MEG3
Human cells – like those of many other organisms – have developed mechanisms to protect us from cancer. Healthy cells produce a suite of molecules that stop harmful mutations from accumulating. The most famous guardian of our genome is the protein p53: whenever p53 becomes inactive or is malfunctioning, the risk of developing cancer increases sharply. MEG3, which has been studied in detail by Marco Marcia and his group at EMBL Grenoble, is another cancer-preventing molecule that our cells produce. Its function arises from stimulating p53. However, unlike p53, MEG3 is not a protein and belongs to a class of RNA molecules discovered within the last 20 years, called long non-coding RNAs; lncRNAs for short. While human cells likely contain more lncRNAs than proteins, the biological importance and mechanisms of action of these RNAs remain largely obscure. Some lncRNAs, like MEG3, are linked to diseases, but scientists have not been able to decipher how they work exactly. This has triggered scepticism among some researchers in the field, says Marcia: “Because of the lack of molecular understanding of how lncRNAs work, many scientists still question the actual functional relevance of these molecules.”
Why shape and function are interlinked
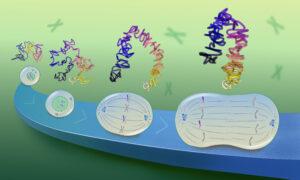
Marcia’s aim was to change this perception, by studying the three-dimensional shape of lncRNAs. He and his group hope that knowing more about lncRNA structures will help to understand how these molecules function. “3D structures provide the molecular map, the molecular cartography of biological molecules. When one visits a new city, one wants to know where the railway station is, where the city hall, the schools, the parks are, because those are the elements of the city that make it function properly. The same is true for biomolecules: you want to know how they are folded and structured so that you can identify their functional units,” says Marcia. Using biochemistry, cell biology and single-particle atomic force microscopy, the team studied the structure of MEG3 in great detail. The group systematically removed and modified the building blocks of MEG3, to find out which of them are essential for its functionality. This way, the researchers discovered two elements inside the molecule that are more important for its function as a tumour suppressor than others. Interestingly, these elements form hairpin structures, which biologists call ‘kissing loops’, that interact with each other in three dimensions. When these kissing loops were disrupted by manipulating the building blocks of MEG3, the tumour suppression function of MEG3 was also disrupted. The findings of the group might have wider implications, explains Marcia: “The fact that the 3D structure of lncRNAs is important sheds new light on these molecules. It shows that lncRNA molecules are much more sophisticated than we thought, because they need to be controlled and folded very precisely to work properly.”
Improving diagnosis and treatment of brain cancer
MEG3 is abundant in different mammalian tissues, particularly the brain and endocrine glands like the pituitary gland. Tumours in the brain and the pituitary gland can develop when MEG3 is not working properly. To date, these types of tumours can only be treated by surgery. One way of overcoming the need for invasive surgery would be to stimulate MEG3 activity in the tumour. Designing drugs that stabilise the MEG3 kissing loops might improve its tumour suppressor function to the point where it can arrest tumour growth. Knowledge about the composition of healthy MEG3 might also help to identify people with abnormally folded MEG3 who are at higher risk of developing cancer.
The unsolved mysteries around MEG3 and other lncRNAs
Despite their meticulous work, the group has not solved the whole puzzle surrounding MEG3, emphasises Marcia: “We still need to discover the precise order of events that lead to MEG3-dependent activation and stimulation of p53.” The results provided in this new paper, which also includes contributions from colleagues at the Institut de Biologie Structurale (Grenoble), the Department CIBIO (University of Trento) and the Max Delbrück Center (Berlin), present the most detailed molecular insight into a lncRNA to date, but trigger the question whether 3D structures are equally important for the function of other lncRNAs. Marcia and his group want to continue analysing the structure and function of further lncRNAs. However, it will be impossible for them alone to study the many thousands of lncRNAs that human cells produce. “I truly hope that the methods and experimental approach we have followed will stimulate other colleagues in the community and help us expand the characterisation of lncRNAs,” says Marcia.
‘Des boucles s’embrassant’ dans une molécule d’ARN, indispensables à son rôle dans la suppression de tumeurs
Une équipe de chercheurs du groupe Marcia à l’EMBL Grenoble, France, a découvert que le suppresseur de tumeur MEG3 adopte une structure tri-dimensionnelle complexe pour accomplir sa fonction. En outre, ils ont été en mesure d’affiner son activité par une manipulation cible de son architecture. Les résultats de cette étude, publiée dans Molecular Cell, peuvent peut-être aider à faire progresser le diagnostic et le traitement de certains types de cancer.

La puissance et le mystère de MEG3
Les cellules humaines, comme celles de nombreux organismes, ont développé des mécanismes pour nous protéger du cancer. Les cellules saines produisent une suite de molécules qui empêchent les mutations nocives de s’accumuler. La gardienne la plus connue de notre génome est la protéine p53 : quand p53 devient inactive ou ne fonctionne pas correctement, le risque de développer un cancer augmente fortement. MEG3, qui a été étudiée en détail par Marco Marcia et son groupe à l’EMBL, Grenoble, est une autre molécule permettant d’éviter le cancer que nos cellules produisent. Sa fonction découle de la stimulation de p53. Toutefois, contrairement à p53, MEG3 n’est pas une protéine et appartient à une classe de molécules ARN découvertes au cours des 20 dernières années, appelée les ARN non codantes longues ; ARNlnc en abrégé.
Alors que les cellules humaines ont tendance à contenir plus d’ARNlnc que de protéines, l’importance biologique et les mécanismes d’action de ces ARN restent grandement obscures. Certaines ARNlnc, comme MEG3, sont liées aux maladies, mais les scientifiques n’ont pas été capables de déchiffrer comment ces ARNs fonctionnent exactement. Ceci a déclenché un scepticisme parmi certains chercheurs dans ce domaine, déclare Marcia : “En raison du manque de compréhension moléculaire de la façon dont les ARNlnc fonctionnent, de nombreux scientifiques questionnent encore la pertinence fonctionnelle actuelle de ces molécules.”
Pourquoi la forme et la fonction sont interconnectées
L’objectif de Marcia était de changer cette perception, en étudiant la forme tri-dimensionnelle des ARNlnc. Marcia et son groupe espèrent que le fait d’en savoir plus sur les structures ARNlnc aidera à comprendre la façon dont ces molécules fonctionnent.
“Les structures 3D fournissent la carte moléculaire, la cartographie moléculaire des molécules biologiques. Quand on visite une nouvelle ville, on cherche à savoir où se trouvent la gare, la mairie, les écoles, les parcs, parce que ce sont les éléments de la ville qui la font fonctionner correctement. C’est de même pour les bio molécules : on cherche à savoir comment elles sont repliées et structurées afin de pouvoir identifier leurs unités fonctionnelles, ” dit Marcia.
En utilisant la biochimie, la biologie cellulaire et la microscopie de force atomique à particule unique, l’équipe a étudié la structure de MEG3 dans tous ses détails. Le groupe a systématiquement retiré et modifié les blocs de construction de MEG3 afin de découvrir lesquels sont essentiels pour sa fonctionnalité. C’est ainsi que les chercheurs ont découvert deux éléments à l’intérieur de la molécule qui sont plus importants que les autres pour sa fonction en tant que suppresseur de tumeur. Ce qui est intéressant, c’est que ces éléments forment des structures en épingle à cheveux, que les biologistes appellent « Boucles s’embrassant », qui interagissent les unes avec les autres dans trois dimensions.
Quand ces boucles s’embrassant étaient interrompues par la manipulation des blocs de construction de MEG3, la fonction de suppression de la tumeur de MEG3 était aussi interrompue. Les découvertes du groupe peuvent avoir des implications plus larges, explique Marcia : “Le fait que la structure 3D des ARNlnc est importante jette un nouvel éclairage sur ces molécules. Cela montre que les ARNlnc sont beaucoup plus sophistiquées que nous pensons, car elles ont besoin d’être contrôlées et repliées très précisément afin de fonctionner correctement.”
Améliorer le diagnostic et le traitement du cancer du cerveau
MEG3 est une molécule abondante dans différents tissus mammaliens, en particulier le cerveau et les glandes endocrines comme l’hypophyse. Des tumeurs dans le cerveau et l’hypophyse peuvent se développer quand MEG3 ne fonctionne pas correctement. A cette date, ces types de tumeurs ne peuvent être traitées que par la chirurgie. Une façon de dépasser le besoin d’une chirurgie invasive serait de stimuler l’activité de MEG3 dans la tumeur.
Concevoir des médicaments qui stabilisent les boucles s’embrassant de MEG3 pourrait améliorer sa fonction de suppresseur de tumeur au point qu’elle pourrait stopper la croissance de la tumeur. Les connaissances relatives à la composition de MEG3 saines pourraient également aider à identifier les personnes ayant des MEG3 repliées de façon anormale qui présentent donc un risque plus important de développer un cancer.
Les mystères non résolus autour de MEG3 et autres ARNlnc
Malgré son travail méticuleux, le groupe n’a pas résolu l’ensemble de l’énigme entourant MEG3, souligne Marcia : “Nous avons encore besoin de découvrir l’ordre précis des événements qui mènent à l’activation et à la stimulation de p53 de la part de MEG3.”
Les résultats fournis dans ce nouvel article, qui comprend aussi les contributions de collègues de l’Institut de Biologie Structurale (Grenoble), du département CIBIO (Université de Trente) et du Max Delbrück Center (Berlin), présentent les informations approfondies moléculaires les plus détaillées dans une ARNlnc à ce jour, mais soulèvent des questions pour savoir si les structures 3D sont tout aussi importantes pour la fonction d’autres ARNlnc. Marcia et son groupe veulent continuer à analyser la structure et la fonction d’autres ARNlnc. Il sera toutefois impossible pour eux seuls d’étudier les nombreux milliers d’ARNlnc que les cellules humaines produisent. “J’espère vraiment que les méthodes et l’approche expérimentale que nous avons suivies stimuleront d’autres collègues dans la communauté pour prendre le relais de notre étude et nous aider à étendre la caractérisation des IncRNA,” dit Marcia.
‘Küssende Schleifen’ in RNA-Molekül essentiell für Tumorunterdrückung
Ein Forscherteam am EMBL Grenoble, Frankreich, hat entdeckt, dass der Tumorsuppressor MEG3 eine komplexe dreidimensionale Struktur annimmt, um seine Funktion zu erfüllen. Darüber hinaus konnten sie seine Aktivitäten durch gezielte Manipulation dieser Architektur verfeinern. Die Ergebnisse dieser Studie, die in der Zeitschrift Molecular Cell veröffentlicht wurden, könnten dabei helfen, die Diagnose und Behandlung bestimmter Krebsarten voranzutreiben.

Die Kraft und das Geheimnis von MEG3
Menschliche Zellen haben – wie viele andere Organismen auch – Mechanismen entwickelt, um uns vor Krebs zu schützen. Gesunde Zellen produzieren eine Reihe von Molekülen, die das Ansammeln schädlicher Mutationen verhindern. Der bekannteste Hüter unseres Genoms ist das Protein p53: Wenn p53 inaktiv wird oder nicht mehr richtig funktioniert, steigt das Risiko, Krebs zu entwickeln, stark an. MEG3, das von Marco Marcia und seiner Gruppe am EMBL Grenoble ausführlich untersucht wurde, ist ein weiteres krebspräventives Molekül, das unsere Zellen produzieren. Seine Funktion ergibt sich aus der Stimulation von p53. Im Gegensatz zu p53 ist MEG3 jedoch kein Protein und gehört zu einer Klasse von RNA-Molekülen, die in den letzten 20 Jahren entdeckt wurden, den sogenannten langen nichtcodierenden RNAs; kurz lncRNAs.
Während menschliche Zellen wahrscheinlich mehr lncRNAs als Proteine enthalten, sind die biologische Bedeutung und die Wirkmechanismen dieser RNAs noch weitgehend unklar. Einige lncRNAs, wie MEG3, sind mit Krankheiten verbunden, aber Wissenschaftler konnten bisher nicht entschlüsseln, wie sie genau funktionieren. Dies hat bei einigen Forschern Skepsis ausgelöst, sagt Marcia: “Aufgrund des fehlenden molekularen Verständnisses der Funktionsweise von lncRNAs stellen viele Wissenschaftler immer noch die tatsächliche funktionelle Relevanz dieser Moleküle in Frage.”
Warum Form und Funktion miteinander verknüpft sind
Marcia’s Ziel war es, diese Wahrnehmung zu ändern, indem er die dreidimensionale Form von lncRNAs studierte. Er und seine Gruppe hoffen, dass das Wissen um die lncRNA-Strukturen helfen wird, zu verstehen, wie diese Moleküle funktionieren.
“3D-Strukturen liefern die molekulare Karte, die molekulare Kartographie biologischer Moleküle. Wenn man eine Stadt zum ersten Mal besucht, will man wissen, wo der Bahnhof ist, wo sich das Rathaus, die Schulen, die Parks befinden. Denn das sind die Elemente der Stadt, die sie zum Funktionieren bringen. Das Gleiche gilt für Biomoleküle: Man will wissen, wie sie gefaltet und strukturiert sind, damit man ihre funktionierenden Einheiten identifizieren kann,” sagt Marcia.
Mit Hilfe von Biochemie, Zellbiologie und Rasterkraftmikroskopie untersuchte das Team die Struktur von MEG3. Systematisch wurden die Bausteine von MEG3 entfernt und modifiziert, um herauszufinden, welche von ihnen wesentlich für ihre Funktionalität sind. Auf diese Weise entdeckten die Forscher zwei Elemente im Inneren des Moleküls, die für seine Funktion als Tumorsuppressor wichtiger sind als andere. Interessanterweise bilden diese Elemente Haarnadelstrukturen, die von Biologen als Kissing Loops (“küssende Schleifen”) bezeichnet werden und die dreidimensional miteinander interagieren.
Als diese Kissing Loops durch Manipulation der Bausteine von MEG3 gestört wurden, wurde auch die Tumorunterdrückungsfunktion von MEG3 gestört. Die Erkenntnisse der Forschergruppe könnten weitreichende Auswirkungen haben, erklärt Marcia: “Die Tatsache, dass die 3D-Struktur von lncRNAs wichtig ist, wirft ein neues Licht auf diese Moleküle. Es zeigt, dass lncRNA-Moleküle viel komplexer sind, als wir dachten, denn sie müssen kontrolliert und sehr präzise gefaltet werden, um richtig zu funktionieren.”
Verbesserung der Diagnose und Behandlung von Hirnkrebs
MEG3 ist in verschiedenen Geweben von Säugetieren reichlich vorhanden – insbesondere im Gehirn und in den endokrinen Drüsen wie der Hypophyse. Tumore im Gehirn und in der Hypophyse können entstehen, wenn MEG3 nicht richtig funktioniert. Bislang können diese Tumorarten nur operativ behandelt werden. Eine Möglichkeit, die Notwendigkeit einer invasiven Operation zu umgehen, wäre die Stimulierung der MEG3-Aktivität im Tumor.
Die Entwicklung von Medikamenten, die die MEG3- Kissing Loops stabilisieren, könnte die Funktion des Tumorsuppressors so weit verbessern, dass er das Tumorwachstum stoppen kann. Das Wissen über die Zusammensetzung von gesundem MEG3 könnte auch dabei helfen, Menschen mit abnormal gefaltetem MEG3 – und damit einem höheren Krebsrisiko – zu identifizieren.
Die ungelösten Rätsel um MEG3 und andere lncRNAs
Trotz ihrer akribischen Arbeit hat die Gruppe nicht das gesamte Rätsel um MEG3 gelöst, wie Marcia betont: “Wir müssen noch den genauen Ablauf der Ereignisse herausfinden, die zu einer MEG3-abhängigen Aktivierung und Stimulation von p53 führen.”
Die enthaltenen Ergebnisse in der Publikation – an der auch Wissenschaftler vom Institut de Biologie Structurale (Grenoble), der Abteilung CIBIO (Universität Trento) und des Max-Delbrück-Centers (Berlin) mitgearbeitet haben – stellen den bisher detailliertesten molekularen Einblick in eine lncRNA dar. Gleichzeitig führen sie aber zu der Frage, ob 3D-Strukturen für die Funktion anderer lncRNAs ebenso wichtig sind. Marcia und seine Gruppe wollen die Struktur und Funktion anderer lncRNAs weiter analysieren. Allerdings wird es für sie allein unmöglich sein, die vielen tausend lncRNAs zu untersuchen, welche von menschlichen Zellen produziert werden. “Ich hoffe sehr, dass die Methoden und der experimentelle Ansatz, den wir verfolgt haben, andere Kollegen in der Gemeinschaft dazu anregen werden, den Staffelstab aus unserer Studie zu übernehmen und uns zu helfen, die Charakterisierung von lncRNAs zu erweitern”, sagt Marcia.
I “kissing loop” di una molecoa di RNA sono fondamentali per la sua funzione di soppressore tumorale
Un team di ricercatori appartenente al gruppo Marcia presso il Laboratorio Europeo di Biologia Molecolare (EMBL) di Grenoble, in Francia, ha scoperto che l’oncosoppressore MEG3 adotta una complessa struttura tridimensionale per svolgere il proprio compito. Il team è inoltre riuscito a investigarne più approfonditamente il funzionamento, tramite una manipolazione mirata della sua struttura. I risultati di questo studio, pubblicati su Molecular Cell, potrebbero contribuire al progresso nella diagnosi e nel trattamento di alcuni tipi di tumori.

Il potere e il mistero di MEG3
Le cellule umane, come quelle di molti altri organismi, hanno sviluppato meccanismi per proteggerci dai tumori. Le cellule sane producono una serie di molecole che impediscono l’accumulo di mutazioni dannose. Il guardiano del genoma più celebre è la proteina p53: ogni volta che p53 diventa inattiva o presenta un malfunzionamento, si verifica un forte aumento del rischio di sviluppare un tumore. MEG3, studiata approfonditamente da Marco Marcia e dal suo gruppo all’EMBL di Grenoble, è un’altra molecola prodotta dalle nostre cellule che contribuisce a prevenire i tumori. La sua funzione consiste nello stimolare la proteina p53. Tuttavia, al contrario di p53, MEG3 non è una proteina, bensì appartiene a un gruppo di molecole di RNA scoperte negli ultimi 20 anni chiamate RNA lunghi non codificanti, abbreviato in lncRNA.
Benché sia probabile che le cellule umane contengano più lncRNA che proteine, l’importanza biologica e i meccanismi d’azione di queste molecole di RNA restano in gran parte sconosciuti. Alcuni lncRNA, come MEG3, sono legati a malattie. Tuttavia, gli scienziati non sono ancora riusciti a capirne l’esatto funzionamento. Questo ha contribuito a diffondere scetticismo tra alcuni ricercatori del settore. “Poiché il funzionamento molecolare dei lncRNA non è ancora stato pienamente compreso, molti scienziati continuano a mettere in dubbio l’effettiva rilevanza funzionale di tali molecole” afferma Marcia.
Perché forma e funzione sono interdipendenti?
L’obiettivo di Marcia è quello di cambiare questa percezione attraverso lo studio della forma tridimensionale dei lncRNA. Insieme al suo gruppo, spera che una conoscenza più approfondita delle strutture dei lncRNA possa aiutare a comprendere il modo in cui funzionano queste molecole.
“Le strutture 3D forniscono la mappa molecolare, la cartografia delle molecole biologiche. Quando si visita una nuova città, sapere dove si trovano la stazione ferroviaria, il municipio, le scuole e i parchi è importante, poiché si tratta degli elementi che contribuiscono al corretto funzionamento della città stessa. Lo stesso può dirsi delle biomolecole: è importante sapere come è ripiegata o organizzata la loro struttura, in modo da poterne identificare le unità funzionali”, sostiene Marcia.
Grazie alla biochimica, alla biologia cellulare e all’utilizzo di un microscopio a forza atomica a singola particella, il team ha studiato dettagliatamente la struttura della molecola MEG3. Il gruppo ha sistematicamente rimosso e modificato gli elementi costitutivi di MEG3, per scoprire quali sono essenziali alla sua funzionalità. In questo modo, i ricercatori hanno identificato due elementi all’interno della molecola più importanti rispetto ad altri in quanto soppressori tumorali. È interessante notare che questi elementi formano strutture a forcina, denominate ‘kissing loop’ dai biologi, che interagiscono tra loro in tre dimensioni.
Distruggendo questi “kissing loop” attraverso una manipolazione degli elementi costitutivi della molecola MEG3, anche la funzione di soppressore tumorale di MEG3 viene interrotta. Le scoperte dei ricercatori potrebbero avere implicazioni più ampie. “L’importanza delle strutture 3D dei lncRNA contribuisce a gettare nuova luce su queste molecole”, spiega Marcia. “Dimostra infatti che i lncRNA sono molto più complessi di quanto pensavamo perché devono essere controllati e ripiegati in maniera estremamente precisa per poter funzionare correttamente.”
Migliorare diagnosi e cura dei tumori al cervello
Nei mammiferi, la molecola MEG3 è largamente diffusa in diversi tessuti, in particolare nel cervello e nelle ghiandole endocrine, come l’ipofisi. I tumori al cervello e all’ipofisi possono svilupparsi quando la molecola MEG3 non funziona correttamente. Finora, l’unico trattamento possibile per queste tipologie di tumori è quello chirurgico. Per ovviare alla necessità di ricorrere ad interventi chirurgici invasivi, si potrebbe ricorrere alla stimolazione dell’attività della molecola MEG3 nel tumore.
Creare medicinali che stabilizzino i “kissing loop” della molecola MEG3 potrebbe migliorarne la funzione di soppressore tumorale fino ad arrestare la crescita tumorale. Conoscere la composizione e la struttura della molecola MEG3 sana potrebbe inoltre contribuire all’identificazione di persone con molecole di MEG3 anormalmente ripiegate, che sono quindi più a rischio di sviluppare un cancro.
I misteri irrisolti della molecola MEG3 e degli altri lncRNA
Nonostante il meticoloso lavoro svolto, il gruppo non è riuscito a decifrare completamente il mistero che circonda la molecola MEG3. “Dobbiamo ancora identificare l’ordine preciso degli eventi che portano all’attivazione e alla stimolazione di p53 da parte di MEG3”, sottolinea Marcia.
I risultati illustrati in questo nuovo articolo, che vanta anche i contributi di colleghi dell’Institut de Biologie Structurale (laboratorio di biologia strutturale, Grenoble), del dipartimento “CIBIO” (Centro di Biologia Integrata, Università di Trento) e del Max Delbrück Center (centro Max Delbrück, Berlino), mostrano la visione molecolare più dettagliata di un lncRNA finora mai realizzata. Tuttavia, inducono a domandarsi se le strutture 3D siano ugualmente importanti per la funzione di altri lncRNA. Marcia e il suo gruppo vogliono continuare ad analizzare la struttura e la funzione di altri IncRNA. Tuttavia, da soli non riusciranno mai a studiare le tante migliaia di lncRNA prodotte dalle cellule umane. “Spero davvero che le metodologie e l’approccio sperimentale che abbiamo seguito stimoleranno altri colleghi della comunità scientifica a raccogliere il testimone e aiutarci ad espandere la rappresentazione dei lncRNA”, commenta Marcia
Los ‘bucles en horquilla’ en una molécula de ARN son esenciales por su papel en la supresión tumoral
Un equipo de investigadores del grupo Marcia del EMBL de Grenoble, Francia, ha descubierto que el supresor tumoral MEG3 adopta una compleja estructura tridimensional para cumplir su función. Además, fueron capaces de afinar su actividad mediante la manipulación selectiva de esta arquitectura. Los resultados de este estudio, publicados en Molecular Cell, podrían ayudar a avanzar en el diagnóstico y tratamiento de ciertos tipos de cáncer.

El poder y el misterio de MEG3
Las células humanas, como las de muchos otros organismos, han desarrollado mecanismos para protegernos del cáncer. Las células sanas producen una serie de moléculas que impiden la acumulación de mutaciones dañinas. El guardián más famoso de nuestro genoma es la proteína p53; cuando p53 se vuelve inactiva o funciona mal, el riesgo de desarrollar cáncer aumenta drásticamente. MEG3, estudiado en detalle por Marco Marcia y su grupo en el EMBL de Grenoble, es otra molécula de prevención del cáncer que nuestras células producen. Su función consiste en la estimulación de p53. Sin embargo, a diferencia de p53, MEG3 no es una proteína, sino que pertenece a una clase de moléculas de ARN descubiertas en los últimos 20 años, llamadas ARNs largos no codificantes: ARNlnc para abreviar.
Mientras que las células humanas probablemente contienen más ARNlnc que proteínas, la importancia biológica y los mecanismos de acción de estos ARNs siguen siendo un misterio. Algunos ARNlnc, como MEG3, están relacionados con enfermedades, pero los científicos no han sido capaces de descifrar cómo funcionan exactamente. Esto ha provocado escepticismo entre algunos investigadores en el campo, dice Marcia. “Debido a la falta de comprensión de cómo funcionan los ARNlnc a nivel molecular, muchos científicos todavía cuestionan la relevancia funcional real de estas moléculas.”
Por qué la forma y la función están interrelacionadas
El objetivo de Marcia era cambiar esta percepción y estudiar la forma tridimensional de los ARNlnc. Junto a su equipo, esperan que al profundizar más en las estructuras del ARNlnc, se llegue a comprender mejor cómo funcionan estas moléculas.
“Las estructuras 3D proporcionan el mapa molecular, la cartografía molecular de las moléculas biológicas. Cuando se visita una nueva ciudad, se quiere saber dónde está la estación de ferrocarril, el ayuntamiento, las escuelas, los parques, porque ésos son los elementos que hacen funcionar la ciudad correctamente. Lo mismo ocurre con las biomoléculas: se necesita saber cómo están plegadas y estructuradas para poder identificar sus unidades funcionales”, dice Marcia.
Mediante la bioquímica, la biología celular y la microscopía de fuerza atómica de partículas individuales, el equipo estudió la estructura de MEG3 con gran detalle. Eliminaron y modificaron sistemáticamente los bloques de construcción de MEG3 para averiguar cuáles de ellos eran esenciales en su funcionalidad. De esta manera, los investigadores descubrieron dos elementos dentro de la molécula que eran más importantes para su función como supresor tumoral que otros. Curiosamente, estos elementos forman estructuras de horquilla, lo que los biólogos llaman “bucles en horquilla”, y que interactúan entre sí en tres dimensiones.
Cuando se alteraron estos bucles en horquilla por la manipulación de los elementos constitutivos de MEG3, la función de supresión tumoral de MEG3 también se vio interrumpida. Los hallazgos de los investigadores podrían tener implicaciones más amplias, como explica Marcia: “El hecho de que la estructura tridimensional de los ARNlnc sea tan importante arroja nueva luz sobre estas moléculas. Demuestra que las moléculas de ARNlnc son mucho más sofisticadas de lo que pensábamos, porque necesitan estar controladas y plegadas con mucha precisión para funcionar correctamente.”
Mejorar el diagnóstico y el tratamiento del cáncer cerebral
MEG3 abunda en diferentes tejidos de mamíferos, particularmente en el cerebro y las glándulas endocrinas, como la glándula pituitaria. Los tumores en el cerebro y la glándula pituitaria se pueden desarrollar cuando MEG3 no está funcionando adecuadamente. Hasta la fecha, este tipo de tumores sólo pueden tratarse mediante cirugía. Una forma de superar la necesidad de la cirugía invasiva sería estimular la actividad de MEG3 en el tumor.
El diseño de fármacos que estabilicen los bucles en horquilla de MEG3 podría mejorar su función supresora tumoral hasta el punto de poder detener el crecimiento tumoral. El conocimiento sobre la composición de MEG3 saludable también podría ayudar a identificar a las personas con MEG3 anormalmente plegado y, por lo tanto, con mayor riesgo de desarrollar un cáncer.
Los misterios sin resolver en torno a MEG3 y otros ARNlnc
A pesar de su meticuloso trabajo, el equipo no ha resuelto aún todo el rompecabezas que rodea a MEG3, como subraya Marcia: “Todavía tenemos que descubrir el orden preciso de los acontecimientos que conducen a la activación y a la estimulación de p53 por parte de MEG3.”
Los resultados proporcionados en este nuevo artículo, que también incluye contribuciones de colegas del Institut de Biologie Structurale (Grenoble), del Departamento CIBIO (Universidad de Trento) y del Max Delbrück Center (Berlín), presentan la visión molecular más detallada de un ARNlnc hasta la fecha, pero suscitan la pregunta de si las estructuras 3D son igualmente importantes para la función de otros ARNlnc. El equipo de Marcia quiere seguir analizando la estructura y la función de otros ARNlnc. Sin embargo, les será imposible por sí solos estudiar los tantos miles de ARNlnc que producen las células humanas. «Espero de verdad que los métodos y el enfoque experimental que hemos seguido estimulen a otros colegas de la comunidad para tomar el relevo de nuestro estudio, y que así nos ayuden a expandir la caracterización de los ARNlnc», dice Marcia.